Метиленовый синий и другие красители в микроскопии
Как приготовить образец для изучения в микроскопе?
Для изучения микроорганизмов производят микроскопирование как живых, так и убитых микробов в неокрашенном и окрашенном виде.
Микроскопический препарат готовят на предметном стекле. Предметные стекла должны быть кристально чисты и абсолютно обезжирены. На поверхности обезжиренного стекла вода легко расплывается и не образует капель шаровидной формы.
Новые стекла перед употреблением кипятят в 1%-ном растворе соды 10 минут, промывают водой, слабой соляной кислотой и хорошо прополаскивают в дистиллированной воде. 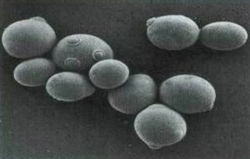
Дочерние и родовые шрамы на поверхности дрожжевых клеток.
Стекла после исследования надо обработать раствором серной кислоты в течение 2 часов, хорошо промыть в воде и прокипятить 10 минут в 4%-ном растворе соды. Ополоснутые затем дистиллированной водой стекла протирают чистой полотняной тканью.
Хранить предметные стекла лучше всего в банке с притертой пробкой, погруженными в смесь спирта с эфиром, взятых в равных объемах. Из банки предметные стекла достают пинцетом.
Покровные стекла - тонкие стеклышки (толщиной 0,15-0,17 мм) размерами обычно 18х18 мм, 20х20 мм, 18х24 мм. Ими накрывают препарат на предметном стекле для изучения.
Как приготовить раствор метиленового синего
Физиологический раствор натрия хлорида с метиленовым синим: метиленовый синий 0,1 г; физиологический раствор натрия хлорида -100,0 мл. Отвешивают указанное выше количество метиленового синего и помещают его в чистую бутылку. Прибавляют физиологический раствор натрия хлорида и тщательно перемешивают до полного растворения кристаллов краски. Для работы фильтруют небольшое количество раствора краски в капельницу.
Техника приготовления краски из сухого порошка. Некоторое количество порошка малахитового зеленого или метиленового синего растирают пестиком в чистой сухой ступке. Отвешивают 3 г порошка краски, насыпают его в бутылку и прибавляют дистиллированную воду, чтобы получилось 100 мл раствора. Для приготовления рабочего раствора наливают 1 мл одного из полученных выше 3%-х водных растворов краски в бутылочку емкостью 250 мл. Прибавляют 100 мл глицерина и 100 мл дистиллированной воды; перед использованием раствор тщательно перемешивают.
Где взять метиленовый синий?

Коврик, скальпель, метиленовый синий.
Если у вас домашний микроскоп, возникает вопрос, где брать препараты?
Всё очень просто: этот препарат продаётся в магазинах, он используется в аквариумистике. Смотрите на фото. Также для приготовления препаратов для микроскопа пригодится скальпель и коврик для резки (безопасный, вы не будете царапать под ним стол, он самовосстанавливающийся).
На фото - коврик для резки, скальпель и бутылочка метиленового синего. Всё приобретено в самом обычном (не специализированном) интернет-магазине.

Метиленовый синий - это ещё и кондиционер для аквариумной воды, стоит он буквально копейки.

Метиленовый синий для аквариумной воды, описание.

Инструкция к скальпелю, от Maped.

Безопасный коврик для резки удобен для работы со скальпелем.
Исследование микроорганизмов в живом виде
Плесневые грибы и дрожжи лучше рассматривать в живом виде в препарате «раздавленная капля». Клетки этих микроорганизмов относительно крупные, обычно при микроскопировании в живом виде хорошо выявляются их форма, размеры, детали внутреннего строения, характер размножения (почкование, деление, спорообразование и т.д.).
Бактерии чаще рассматривают в мертвом виде на фиксированных окрашенных препаратах (из-за их малого размера). При этом мы получаем более ясное представление о форме и размерах клеток, о способности их к спорообразованию.
В живом виде в «раздавленной капле» бактерии рассматривают в том случае, когда выясняют их способность к движению.
При микроскопировании дрожжей в каплю жидкости на стекле добавляют петлей небольшое количество метиленовой сини (до голубого окрашивания) и эту смесь тщательно размешивают. Окраска живых дрожжей метиленовой синью применяется для того, чтобы выявить мертвые клетки, легко окрашивающиеся в синий цвет. Живые клетки остаются неокрашенными, так как не пропускают краску через свою оболочку.
Приготовленный на предметном стекле препарат дрожжей накрывают покровным стеклом и рассматривают с объективом 40Х. В таком препарате обычно хорошо видны прозрачные овальные или круглые клетки дрожжей с ядрами и оболочками, которые хорошо заметны в клетках живых дрожжей. Мертвые клетки, как правило, более мелкие по сравнению с живыми и окрашены в синий цвет.
Окраска дрожжей метиленовым синим
Наибольшее распространение получил метод выявления мертвых клеток с помощью метиленового синего. После попадания в клеточную цитоплазму под действием ферментов редуктаз этот краситель восстанавливается живыми дрожжевыми клетками до бесцветных соединений. Мертвые клетки окрашиваются в синий цвет. Эффективность данного метода зависит не только от состояния клеточной мембраны, но и от активности оксидоредуктаз в клетке.
Окраска клеток метиленовым синим и сафранином
Более полную информацию о физиологическом состоянии дрожжей дает окрашивание фиксированных препаратов метиленовым синим, танином и сафранином. Сафранин применяется для выявления клеточных ядер, которые окрашиваются в красный цвет. Если клетки живые и содержат оксидоредуктазы, расщепляющие метиленовый синий, то окрашенный препарат приобретает красноватый, а не фиолетовой оттенок.
Реактивы: краситель метиленовый синий; краситель сафранин; 5 %-й раствор танина в воде; физиологический раствор (0,9 %-й раствор NaCl). 
Нанести каплю суспензии дрожжей на обезжиренное мылом предметное стекло. Оставить высыхать на воздухе при комнатной температуре. После высыхания капли зафиксировать препарат (10 раз провести стеклом в пламени спиртовки). Нагревать несильно, не пережигать. Залить стекло раствором метиленового синего и выдержать в течение 4 минут при комнатной температуре. Смыть краситель теплой водой. Залить стекло свежеприготовленным раствором танина на 2 минуты. Смыть краситель под струей воды. Залить на 16 минут стекло раствором сафронина. Смыть краситель. Микроскопирование следует проводить нефлюоресцирующим маслом при увеличении 400х.
Препарат живых бактерий
Препарат живых бактерий готовится подобно препарату дрожжей, но бактерии можно рассматривать и без добавления краски. Препарат рассматривается с иммерсионным объективом 90 X, лучше всего в затемненном поле (т.е. с прикрытой диафрагмой). Если культура бактерий подвижная, то хорошо видны быстрые разнохарактерные движения отдельных клеток.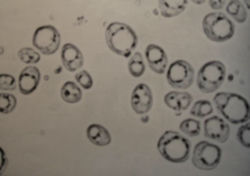
Морфология голодных и старых клеток (фотоувеличение 400х).
Для приготовления препарата плесневых грибов очень осторожно (чтобы не разрушить органов спороношения) специальной иглой (можно препаровальной) или ботаническим пинцетом снимают кусочек пленки гриба и переносят его в каплю воды, предварительно нанесенную на предметное стекло. Препарат осторожно, слегка придавливая, накрывают покровным стеклом и рассматривают под микроскопом с объективом 8Х. При этом увеличении хорошо различается строение органов спороношения плесневых грибов. Для подробного изучения отдельных деталей строения (гиф, сумок и т.д.) препарат рассматривают с объективом 40X.
При приготовлении препаратов в раздавленной капле нужно помнить :
1. При опускании покровного стекла на каплю следует прикоснуться его ребром к краю капли и, постепенно наклоняя, опустить стекло.
2. Капля не должна быть большой, чтобы жидкость не переливалась за края и не попадала на верхнюю сторону покровного стекла. Избыток воды снимите фильтровальной бумагой.
3. Одиночные пузырьки воздуха, оставшиеся под покровным стеклом, обычно не мешают наблюдению. Но если их много, препарат лучше приготовить заново.
4. Препарат не должен быть слишком густым, чтобы микроорганизмы не заслоняли друг друга.
5. Приготовленные препараты рассматривают тут же после приготовления (особенно живых бактерий), так как в иначе вода высыхает и клетки бактерий теряют подвижность.
6. Бактериологическую петлю (или иглу) перед каждым очередным пассажем и после него (нанесение капли воды на стекло, снятие культуры с агара и ее размешивание, взятие краски и т.д.) следует обязательно докрасна прокаливать в пламени горелки. После прокаливания петлю быстро охлаждают на воздухе (держат 2-3 секунды, ни к чему не прикасаясь) и приступают к выполнению очередного этапа работы.
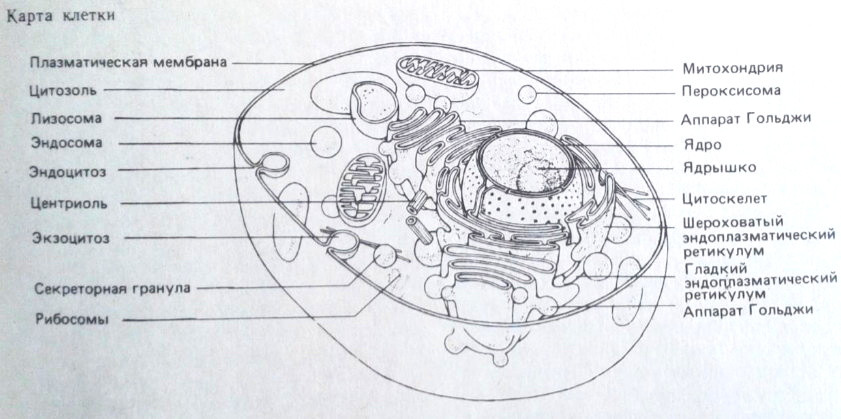
Морфологическая модель клетки.
Простая окраска препаратов
При простой окраске препаратов на фиксированный мазок наливают несколько капель какого-либо красящего раствора (метиленового синего, разведенного фуксина и прочее). Для получения более чистых препаратов рекомендуется красящий раствор наливать на отрезок фильтровальной бумаги, которой покрывают мазок.
Раствор краски в среднем выдерживают на мазке 2-3 минуты (в зависимости от вида краски):
- Фуксин красит интенсивно, причем окрашиваются одинаково хорошо все виды бактерий. Продолжительность окрашивания раствором фуксина вполне достаточна на протяжении 1-2 минут.
- Щелочную метиленовую синь оставляют для окрашивания мазка на 2-3 минуты. Она красит менее сильно, но препарат получается более изящный, к тому же различные бактерии приобретают окраску различной интенсивности. При окраске метиленовой синью у крупных клеток (например, дрожжевых) дифференцируется ядро и цитоплазма.
- Раствор генцианвиолета держат для окраски 3-5 минуты.
Виды красителей для приготовления образцов для микроскопа
Красители в микробиологии являются солями двух типов: 1) кислые красители – у которых ион, придающий окраску (хромофор), является анионом (пример - эозин); 2) основные красители – те, у которых роль хромофора играет катион (пример - метиленовый синий). 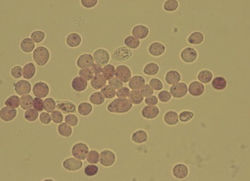
Окраска клеток дрожжей иодонитротетразолиум хлоридом.
Кислые красители являются кислыми потому, что хромофор, будучи кислотой, при образовании придающей окраску соли, связывается с основанием (NaOH).
Красители второго типа называются основными потому, что хромофор, будучи основанием, при образовании соли связывается с кислотой (HCl).
Обычно кислые красители связываются более интенсивно с цитоплазменными (основными) компонентами клетки, а основные – с ядерными (кислыми).
Методы окрашивания основаны либо на микроскопировании в видимом (обычном) свете, либо на флуоресцентной микроскопии. Красителями для светового микроскопа являются метиленовый синий, раствор Люголяи др. Из флуоресцентных красителей применяют магниевую соль 1-анилино-8-нафтален сульфоновой кислоты (Mg-ANS), а также дигидрородамин.
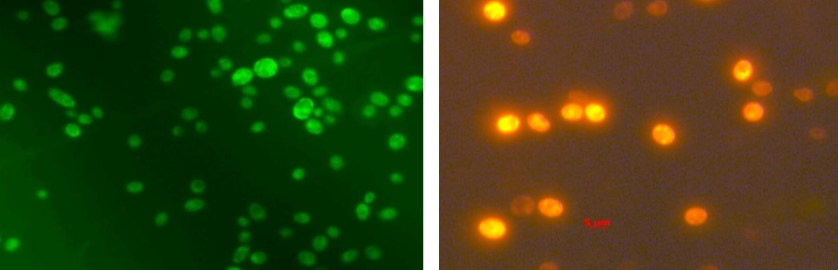
Окраска клеток дигидрородамином в зеленом и красном спектре.
